Ist Ihr Laboraudit bereit — oder hoffen Sie nur auf das Beste?
Erfahren Sie, wie Sie Ihr Laboraudit vorbereiten können. Erfahren Sie, wie Sie mit der SciSure Scientific Management Platform Risiken reduzieren, die Einhaltung von Vorschriften verbessern und die Rückverfolgbarkeit einbetten können.

Download Whitepaper
Die meisten Labore bestehen Audits nicht aufgrund eines einzigen katastrophalen Fehlers. Sie scheitern an hundert kleinen Fehlern, die alle unsichtbar, undokumentiert und nicht behoben werden, bis es zu spät ist.
Aus diesem Grund ist es mehr als nur das Ankreuzen von Kästchen. Es ist ein aussagekräftiger Einblick in den Betriebszustand Ihres Labors und zeigt, wie Ihre Systeme täglich wirklich funktionieren. Und in Laboren, die immer noch mit veralteten Prozessen, verstreuten Tabellen, manuell aktualisierten Schulungsprotokollen oder der Einhaltung von Vorschriften arbeiten, die vom Speicher abhängen, sind die Lücken möglicherweise nicht offensichtlich — bis sie durch ein Audit, einen Vorfall oder eine Klage ans Licht kommen.
Das ist ein Glücksspiel, das sich nur wenige Organisationen leisten können. Heute legen Aufsichtsbehörden, Finanzierungsstellen und interne Interessengruppen die Messlatte höher und erwarten nicht nur Dokumentation, sondern auch Rückverfolgbarkeit. Nicht nur Richtlinien, sondern auch Beweise. Um bereit für ein Audit zu sein, geht es nicht nur um den Tag der Inspektion, sondern um jeden Tag.
Doch obwohl sich die Erwartungen weiterentwickelt haben, haben sich viele Laborinfrastrukturen nicht weiterentwickelt. Altsysteme, Einzellösungen und nicht miteinander verbundene Tools haben zu fragmentierten Ökosystemen geführt, in denen das Risiko nicht sichtbar ist. Manuelle Behelfslösungen sind zu alltäglichen Abläufen geworden. Und Sicherheits-, Inventar- und Schulungssysteme arbeiten oft isoliert von der eigentlichen Forschung.
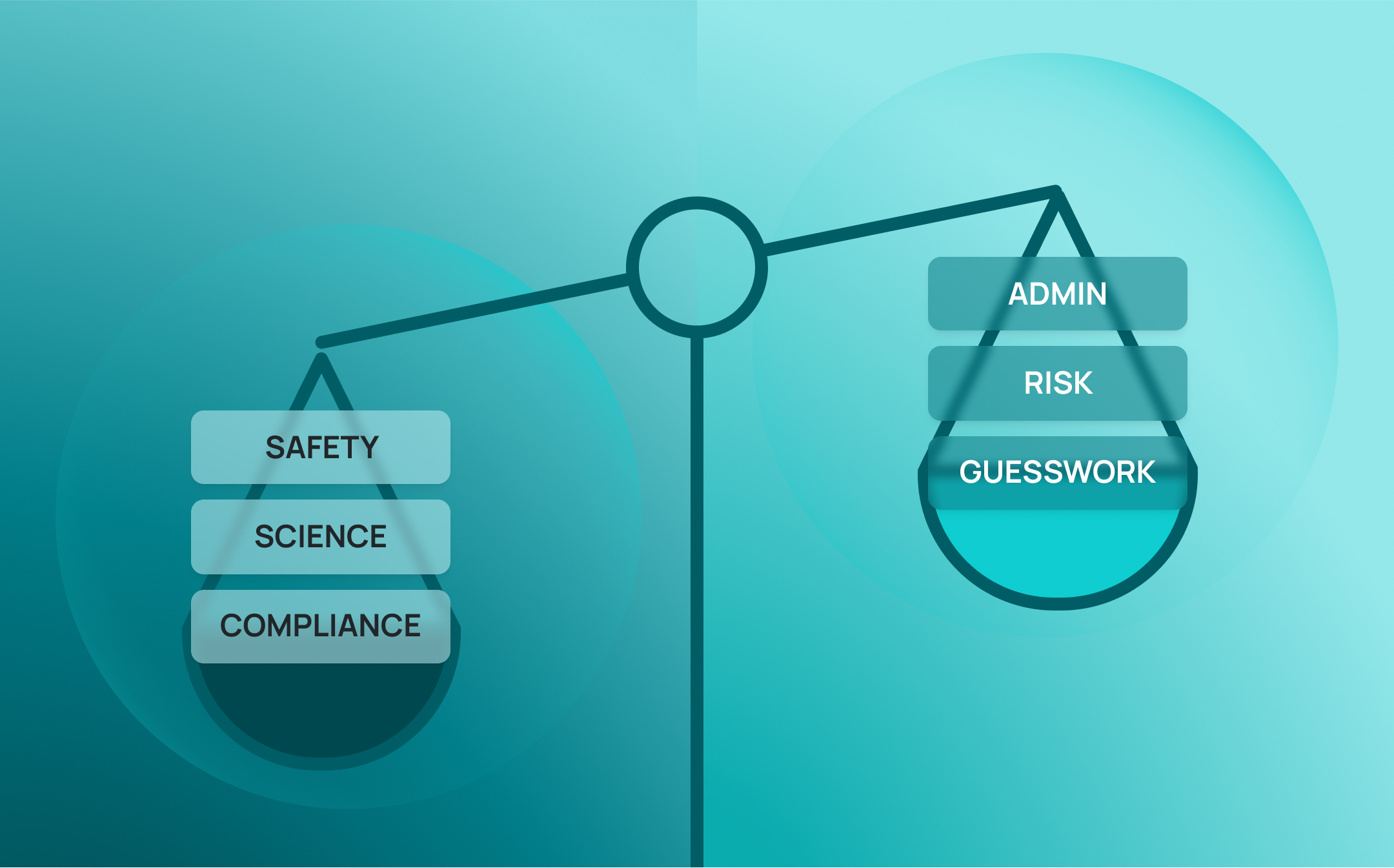
In diesem Whitepaper wird untersucht, wie Auditbereitschaft zu einem wichtigen Indikator für Unternehmensrisiken geworden ist — und was Labore tun können, um die Nase vorn zu haben. Wir untersuchen, wie fragmentierte Systeme Risiken in Bezug auf Reproduzierbarkeit, Sicherheit, Compliance und wissenschaftliche Integrität mit sich bringen — und wie integrierte digitale Systeme wie SciSure Scientific Management Platform (SMP) kann die Auditbereitschaft von einem Gerangel in einen strategischen Vorteil verwandeln.
Auditbereitschaft als wichtiger Faktor zur Risikominderung
Die Vorbereitung auf Audits ist nicht nur ein Meilenstein in Bezug auf die Einhaltung von Vorschriften, sondern auch ein Stresstest für den gesamten Betrieb Ihres Unternehmens. Wenn Sie fragen, „Sind wir bereit für das Audit?“, du fragst wirklich:
- Sind unsere Daten und Aufzeichnungen korrekt, vollständig und zugänglich?
- Sind unsere Mitarbeiter angemessen geschult und auf dem neuesten Stand?
- Sind unsere Systeme ausreichend vernetzt, um klare Antworten zu geben, wenn Fragen gestellt werden?
Wenn die Antwort nein ist, oder „Wir glauben schon“—du trägst bereits ein Risiko.
Angesichts der verschärften behördlichen Kontrolle über Sicherheitslücken in der Praxis bis hin zu zunehmenden Bedenken hinsichtlich der wissenschaftlichen Reproduzierbarkeit erweist sich die Auditbereitschaft als wichtige Schutzmaßnahme. Es handelt sich nicht nur um ein Compliance-Ziel, sondern auch um eine strukturelle Voraussetzung für belastbare, glaubwürdige Wissenschaft.
Risiken in wissenschaftlichen Umgebungen können sich auf verschiedene Arten manifestieren:
- Regulatorisches Risiko: Verstöße können Inspektionen, Bußgelder, Abschaltungen oder sogar rechtliche Schritte nach sich ziehen.
- Operationelles Risiko: Schlechte Transparenz führt zu übersehenen Fehlern, überflüssiger Arbeit und inkonsistenten Verfahren.
- Reputationsrisiko: Eine Sicherheitsverletzung, ein Kontaminationsereignis oder ein Zitat können das Vertrauen jahrelang schädigen.
- Wissenschaftliches Risiko: Wenn Sie Ihre Arbeit nicht reproduzieren oder verfolgen können, können Sie nicht hinter Ihren Ergebnissen stehen.
Steigender regulatorischer Druck
Für Labore auf der ganzen Welt verschärft sich die behördliche Kontrolle. Im Mai 2025 erliess eine US-Exekutivverordnung mit dem Titel “Verbesserung der Sicherheit der biologischen Forschung“ führte weitreichende Änderungen ein, die wissenschaftliche Organisationen dazu verpflichtete, strengere Aufsichtspolitiken umzusetzen. Dazu gehören Durchsetzungsklauseln, öffentliche Berichterstattung und aktualisierte Definitionen dessen, was als riskante Forschung gilt.
Insbesondere gilt die Richtlinie sowohl für staatlich als auch für nicht vom Bund finanzierte Labore, wodurch die staatliche Aufsicht ausgeweitet wird und die Labore verpflichtet sind, transparente Rückverfolgbarkeit, solide Berichterstattung über Vorfälle und eine solide Qualifizierung des Personals nachzuweisen. In der Praxis bedeutet dies eine umfassende Dokumentation der Agenteninventare, Sicherheitsbewertungen, Schulungen und Aufzeichnungen des Laborpersonals sowie überprüfbare Vorfallprotokolle.
Auswirkungen auf die Sicherheit in der realen Welt
Sicherheitslücken in wissenschaftlichen Labors sind nach wie vor weitaus häufiger, als den meisten Unternehmen bewusst ist, und die Folgen können schwerwiegend sein. Eine Beobachtungsstudie aus dem Jahr 2021 mit 220 Labormitarbeitern ergab, dass 45% angaben, während ihrer Laborarbeit mindestens einen Unfall erlitten zu haben1. Darüber hinaus dokumentierte das U.S. Chemical Safety and Hazard Investigation Board (CSB) zwischen 2001 und 2018 120 Unfälle im akademischen Forschungslabor, darunter Chemikalienlecks, Brände und Evakuierungen2. Solche Vorfälle sind häufig auf unzureichende Verfahrenskontrollen, unzureichende Schulungen und fragmentierte Aufzeichnungen zurückzuführen.
Einer der prominentesten Fälle ist nach wie vor der Tod der UCLA-Forscherin Sheri Sangji, die 2008 tödliche Verbrennungen erlitt, nachdem sie ohne angemessene Ausbildung oder Schutzkleidung mit pyrophoren Reagenzien umgegangen war.3. Das daraus resultierende Strafverfahren war die erste US-Strafverfolgung wegen eines Laborunfalls an einer Universität, kostete die UCLA Millionen an Anwaltskosten und schadete ihrem Ruf schwer.
Die Kosten für Ruf und wissenschaftliche Integrität
Abgesehen von Bußgeldern, Klagen und Sicherheitsvorfällen kann eine mangelnde Prüfungsbereitschaft das wertvollste Kapital einer wissenschaftlichen Organisation untergraben: Vertrauen. Wenn Daten nicht zurückverfolgt, reproduziert oder validiert werden können, wird ihre Glaubwürdigkeit — und Ihre — in Frage gestellt. In stark regulierten Bereichen wie Arzneimittelentwicklung, Diagnostik und translationaler Forschung können selbst geringfügige Dokumentationslücken Zulassungsanträge zum Scheitern bringen, klinische Programme zum Erliegen bringen oder Finanzierung und Partnerschaften gefährden.
Reproduzierbarkeitsmängel sind eine weithin anerkannte Krise in der Wissenschaft. EIN Natur Eine Umfrage unter 1.500 Wissenschaftlern ergab, dass mehr als 70% die Ergebnisse eines anderen Forschers nicht reproduzieren konnten und über 50% ihre eigenen Ergebnisse nicht reproduzieren konnten4. Die Ursachen sind zwar multifaktoriell, aber ein schlechtes Datenmanagement und unvollständige Aufzeichnungen tragen maßgeblich dazu bei.
In diesem Zusammenhang geht es bei der Vorbereitung eines Audits um mehr als nur um Inspektionen — es ist ein Schutz der wissenschaftlichen Integrität. Es stellt sicher, dass jeder Schritt, jede Probe und jede Entscheidung aufgezeichnet, zugänglich und vertretbar ist. Ohne diese Grundlage laufen selbst bahnbrechende Ergebnisse Gefahr, verworfen, angefochten oder gänzlich verloren zu gehen. Einfach ausgedrückt: Wenn Sie es nicht beweisen können, können Sie ihm nicht vertrauen, und niemand anderes kann es auch nicht.
Labore, die wirklich auf Audits vorbereitet sind, sind nicht nur auf Inspektionen vorbereitet — sie sind auch für das Unerwartete gerüstet. Sie arbeiten mit vernetzten Systemen, Überwachung in Echtzeit und integrierter Rückverfolgbarkeit, die alltägliche Entscheidungen unterstützt. Vor diesem Hintergrund ist Auditbereitschaft mehr als nur eine Checkbox zur Einhaltung von Vorschriften — sie ist ein Frühindikator für betriebliche Integrität, wissenschaftliche Genauigkeit und institutionelle Vertrauenswürdigkeit.

Wo laufen die Labore schief?
Den meisten Laboren mangelt es nicht an Auditbereitschaft, weil es ihnen an Aufwand oder Fachwissen mangelt. Sie sind oft unzureichend, weil ihre Systeme nie dafür gebaut wurden.
Das Prüfungsrisiko steigt in der Regel langsam und schleicht sich durch die Anhäufung kleiner Lücken und manueller Umgehungslösungen ein, die unbemerkt bleiben, bis es zu spät ist. In Bezug auf Schulung, Inventar, Sicherheit und Dokumentation verlassen sich viele Labore immer noch auf fragmentierte, reaktive und schwer zu überprüfende Prozesse.
Zu den häufigsten Schwachstellen gehören:
- Manuelles Tracking von Schulungen und Kompetenzen: Mitarbeiterzertifizierungen werden häufig in Tabellen oder Papierformularen aufgezeichnet, ohne dass automatische Benachrichtigungen angezeigt werden, wenn die Schulung abläuft. Das macht es schwierig, sicherzustellen, dass das Personal qualifiziert ist — und es ist unmöglich, dies während eines Audits nachzuweisen, ohne Probleme zu haben.
- Isolierte Sicherheitssysteme: Sicherheitsaudits, Chemikalieninventare und Störfallberichte werden häufig in getrennten Geräten aufgezeichnet — unabhängig von den Arbeitsabläufen, in denen das Risiko tatsächlich auftritt. Dadurch entstehen Lücken in der Rückverfolgbarkeit und es wird schwieriger, systemische Probleme zu identifizieren.
- Veraltete Bestandsverwaltung: Labore haben oft Schwierigkeiten, Reagenzien, Proben und Geräte in Echtzeit zu verfolgen. Ohne zuverlässige Inventarprotokolle ist es schwierig, die Kontrollkette aufrechtzuerhalten oder abgelaufene oder missbräuchlich verwendete Materialien zu identifizieren — wichtige Warnsignale bei jeder Inspektion.
- Isolierte Punktlösungen: Selbst wenn digitale Tools existieren, handelt es sich oft um Einzweckanwendungen, die sich nicht integrieren lassen. Dies zwingt Teams dazu, Daten systemübergreifend zu duplizieren — oder schlimmer noch, auf der Grundlage widersprüchlicher Versionen der Wahrheit zu arbeiten.
- Kulturelle Gewohnheiten und institutionelles Gedächtnis: In vielen Laboren lebt kritisches Wissen in den Köpfen erfahrener Mitarbeiter. Wenn dieses Wissen jedoch nicht dokumentiert oder leicht zugänglich ist, können Fluktuation oder Abwesenheiten schnell zu blinden Flecken führen.
- Reaktive Denkweise: Allzu oft werden Probleme erst behoben, wenn etwas schief geht: eine Sicherheitsverletzung, eine fehlgeschlagene Inspektion, eine verpasste Validierung. Bis dahin ist es zu spät, um proaktiv zu handeln.
Diese Lücken bereiten den Laboren Kopfschmerzen, stellen aber auch täglich Risiken dar. Ohne vernetzte, verifizierbare Systeme gehen Labore von Annahmen aus: Sie gehen davon aus, dass jemand die Schulung abgeschlossen hat, dass die Probe protokolliert wurde, vorausgesetzt, das Verfahren wurde befolgt. Wenn Aufsichtsbehörden, Partner oder Führungskräfte nach Beweisen fragen, reicht „unserer Meinung nach“ nicht aus.
Kannst du das Risiko erkennen?
Stellen Sie sich dieses Szenario vor: Ein Auditor verlangt den Nachweis, dass ein Techniker in einem neuen Protokoll mit hohem Risiko geschult wurde, das vor zwei Monaten eingeführt wurde. Sie können sich noch genau an die Schulung erinnern, aber die Tabelle wurde nicht aktualisiert und es ist keine Signatur hinterlegt. In der Zwischenzeit wurden die Namen der Mitarbeiter, die die Schulung abgeschlossen haben, von Hand auf eine Haftnotiz kopiert, die es nie in das System geschafft hat. Was als Routine begann, sieht jetzt wie ein regulatorischer Verstoß aus.
Schneller Realitätscheck:
- Können Sie aktuelle Trainingsaufzeichnungen für jedes Labormitglied in weniger als 5 Minuten abrufen?
- Können Sie die Kontrollkette für ein kritisches Reagenz oder eine wichtige Probe nachweisen, die bei Ihrer letzten behördlichen Einreichung verwendet wurden?
- Sind Ihre SOPs versionskontrolliert, für alle zugänglich und in Ihre täglichen Arbeitsabläufe eingebettet?
Die gute Nachricht ist, dass diese Risiken nicht unvermeidlich sind. Labore, die regelmäßig Prüfungen bestehen, sind nicht auf heldenhafte Anstrengungen angewiesen. Sie verlassen sich auf Systeme, die standardmäßig auf Transparenz, Rückverfolgbarkeit und Konformität ausgelegt sind. Anstatt zu versuchen, Lücken mit mehr Tabellen oder Checklisten zu schließen, investieren sie in eine Infrastruktur, die die Auditfähigkeit in den täglichen Betrieb integriert.
Von der reaktiven zur proaktiven Auditbereitschaft
In einem prüfungsbereiten Labor müssen Sie sich nicht auf die Einhaltung von Vorschriften vorbereiten, sondern darauf achten. Es ist in Ihren täglichen Betrieb integriert und nicht überlagert. Und vor allem ist es sichtbar. Wenn Ihr Labor für Audits bereit ist, kann Ihr Labor wichtige Fragen konsistent, schnell und mit Beweisen beantworten:
- Wer hat diese Probe bearbeitet und wann?
- Wurde das Protokoll genau so befolgt, wie es genehmigt wurde?
- Wurde das Team geschult und für die neuesten SOP angemeldet?
- Wo wurde diese Chemikalie gelagert — und wann ist sie abgelaufen?
- Welche Abhilfemaßnahmen folgten auf den letzten Sicherheitsvorfall?
In Laboren ohne die richtige digitale Infrastruktur befinden sich diese Antworten an einem Dutzend verschiedener Orte: in Tabellenkalkulationen, Papierordnern, Aktenschränken oder noch schlimmer — im Gedächtnis von jemandem. Deshalb geht es bei der Vorbereitung auf Audits nicht nur um Dokumentation. Es geht um Systemdesign.
Wirklich prüfungsbereite Labore haben vier Merkmale gemeinsam:
.jpg)
- Verbunden — Die Daten sind zentralisiert und die Systeme kommunizieren miteinander, sodass Inventar, Schulung, Sicherheit und Forschung nicht isoliert sind.
- Rückverfolgbar — Jedes Material, jede Handlung und jede Entscheidung kann auf eine Person, eine Zeit und einen Datensatz zurückgeführt werden.
- Kontrolliert — SOPs, Workflows und Berechtigungen werden vom System durchgesetzt und nicht manuell übernommen oder umgangen.
- Sichtbar — Probleme werden frühzeitig erkannt, Trends werden in Echtzeit verfolgt, und Prüfer müssen nicht suchen, um das zu finden, was sie benötigen.
Wie das SMP von SciSure das möglich macht
Das SciSure SMP wurde so konzipiert, dass standardmäßig prüfungsbereite Labore erstellt werden. Es vereint wichtige Komponenten des Labormanagements — ELN, LIMS, Inventar, Ausrüstung, Schulung, Sicherheit, Inspektionen und mehr — in einer einzigen, integrierten Umgebung. Anstatt sich in zehn verschiedene digitale Systeme einzuloggen oder sich auf manuelle Behelfslösungen zu verlassen, interagieren Benutzer mit einer einheitlichen Plattform, die reale Arbeitsabläufe im Labor widerspiegelt.
Training, das nachweisbar ist, nicht vorausgesetzt
Das SMP schließt Lücken in der Sichtbarkeit von Schulungen, indem es Schulungen direkt an die Rollen und Verantwortlichkeiten der Benutzer bindet. Der Zugang jedes Labormitglieds wird durch einen klaren Schulungsplan geregelt, in dem die erforderlichen Zertifizierungen den jeweils zulässigen Aufgaben zugeordnet werden. Wenn die Schulung unvollständig oder veraltet ist, verhindert das System aktiv, dass Benutzer risikoreiche Protokolle einführen oder mit sensiblen Materialien umgehen.
Die Aufzeichnungen werden zentral gespeichert und in Echtzeit aktualisiert, sodass das Durchsuchen von Personalakten oder das manuelle Abgleichen von Tabellenkalkulationen entfällt. Mithilfe von Warnmeldungen und Dashboards sind sowohl Wissenschaftler als auch Manager auf einen Blick über bevorstehende Verlängerungen, abgelaufene Schulungen und teamweite Vorschriften auf dem Laufenden.
Kurz gesagt, es wird nicht dem Gedächtnis oder der manuellen Überwachung überlassen. Die Plattform fungiert als integrierter Gatekeeper, der sicherstellt, dass nur die richtigen Personen mit der richtigen Ausbildung die richtigen Arbeiten ausführen können.
In den wissenschaftlichen Arbeitsablauf integrierte Sicherheitsdaten
In den meisten Laboren befinden sich Sicherheitsdaten in einem Silo — gebunden an papiergestützte Formulare, separate EHS-Plattformen oder Ad-hoc-Berichtsprozesse, die nicht in die eigentliche Laborarbeit integriert sind. Das SciSure-SMP beseitigt diese Diskrepanz, indem die Sicherheit direkt in die wissenschaftliche Arbeit integriert wird.
Risikobeurteilungen und Sicherheitskontrollen sind selbst in den Protokollen verankert und nicht erst im Nachhinein festgeschrieben. Forscher werden beim Durchlaufen der Arbeitsabläufe durch die erforderlichen Schritte, Gefahrenkontrollen und PSA-Erinnerungen geführt — so erfolgt die Sicherheit automatisch und nicht optional.
Wenn Vorfälle auftreten, werden sie nicht isoliert behandelt. Das System verknüpft sie mit bestimmten Workflows, Benutzern und Reagenzien. So erhalten Sie umfangreiche Kontextdaten für die Ursachenanalyse. Und da der Chemikalienbestand bis hin zur einzelnen Flasche in Echtzeit verfolgt wird, lässt sich leicht nachvollziehen, um welche Materialien es sich handelte, ob die Lagergrenzen überschritten wurden oder ob inkompatible Substanzen zusammen verwendet wurden.
Dadurch entsteht ein positiver Kreislauf: Sicherheitsdaten bilden die Grundlage für zukünftige Entscheidungen, Trends werden sichtbar und die Rechenschaftspflicht ist von Anfang an eingebaut. Anstatt sich auf reaktive Berichterstattung zu verlassen, baut das Labor eine Kultur der kontinuierlichen Verbesserung auf — in der Risiken erkannt und angegangen werden, bevor sie zu einer Krise werden.
Inventar, Proben und Sorgekette
Das SMP zentralisiert den gesamten Lebenszyklus von Reagenzien, Chemikalien und Proben, von der Bestellung und dem Empfang bis hin zur Verwendung, Lagerung und Entsorgung. Jede Bewegung wird mit Zeitstempeln, Benutzerattributionen und kontextbezogenen Metadaten protokolliert, sodass eine vollständige Kontrollkette mit minimalem manuellem Aufwand gewährleistet ist.
Da das Inventar direkt an die Arbeitsabläufe gebunden ist, kann das System die Verwendung abgelaufener oder nicht autorisierter Materialien einschränken, angemessene Lagerpraktiken durchsetzen und sicherstellen, dass bei regulierten Verfahren nur validierte Eingaben verwendet werden. Wenn etwas schief geht — oder wenn ein Prüfer den Weg einer kritischen Probe zurückverfolgen möchte — wird jeder Schritt dokumentiert und ist leicht abrufbar.
Das Ergebnis ist eine stärkere Kontrolle, weniger blinde Flecken bei der Einhaltung der Vorschriften und eine robustere wissenschaftliche Bilanz.
Dashboards, die Risiken sichtbar machen
Auditbereit zu sein bedeutet, jederzeit zu wissen, wo sich Ihr Labor befindet. Mit SciSure ist Transparenz auf jeder Ebene in die Plattform integriert.
Dashboards geben Laborleitern und EHS-Teams Live-Einblicke in den Schulungsstatus, überfällige SOPs, offene Vorfälle und mehr. Rollenspezifische Berechtigungen stellen sicher, dass jeder Benutzer sieht, was für seine Aufgaben relevant ist — ganz gleich, ob es sich dabei um einen Compliance-Beauftragten handelt, der vergangene Inspektionen überprüft, oder um einen Wissenschaftler, der die Verfügbarkeit von Reagenzien überprüft.
Jede Aktion wird mit einem vollständigen Audit-Trail aufgezeichnet, aus dem hervorgeht, wer was, wann und unter welcher Version des Protokolls getan hat. Nichts ist verborgen, nichts geht verloren und nichts muss im Nachhinein rekonstruiert werden. Wenn Auditoren eintreffen, müssen Sie sich nicht beeilen, den Papierkram zu sammeln. Sie arbeiten bereits mit der Transparenz, die sie erwarten.
Durch die Ausrichtung des Laborbetriebs auf eine einzige, vernetzte Plattform hilft SciSure Laboren dabei, von reaktivem Scrambling zur proaktiven Steuerung überzugehen. Labore verlassen sich nicht auf Speicher, Workarounds oder getrennte Systeme, sondern arbeiten in einer digitalen Umgebung, die Standards durchsetzt, Risiken kennzeichnet und die Rückverfolgbarkeit von Anfang an unterstützt.
Das reduziert nicht nur den Stress bei Inspektionen — es schützt auch Ihre Mitarbeiter, Ihre Wissenschaft und Ihren Ruf.
Risikominderung in ROI umwandeln
Für viele Laborleiter und EHS-Verantwortliche ist die größte Hürde bei der Verbesserung der Auditbereitschaft nicht das Bewusstsein, sondern das Handeln. Selbst wenn die Risiken klar sind, kann es schwierig sein, Führungskräfte davon zu überzeugen, in eine neue Plattform zu investieren. Die Budgets sind knapp, Altsysteme sind fest verwurzelt und die Kosten der Untätigkeit werden oft unterschätzt.
Die Bereitschaft zu Audits wird jedoch zunehmend zu einer geschäftlichen Notwendigkeit. Die Risiken von Verstößen gegen Vorschriften, Sicherheitslücken oder Datenverlust können enorme Kosten in Form von Anwaltskosten, behördlichen Bußgeldern, Betriebsausfällen oder Reputationsschäden nach sich ziehen. Und diese Kosten übersteigen oft bei weitem die Investitionen, die zur Behebung der zugrunde liegenden Probleme erforderlich sind.
Aus diesem Grund besteht der beste Weg, um Unterstützung für Plattformen wie SMP von SciSure zu gewinnen, darin, Risikominderung als Kostenkontrolle zu betrachten. Durch die Umstellung von reaktiver Überwachung auf Transparenz in Echtzeit können Labore Folgendes reduzieren:
- Der Ressourcenaufwand bei der Vorbereitung von Audits
- Redundanz in Schulungs-, Dokumentations- und Inventarsystemen
- Kosten im Zusammenhang mit Sicherheitsvorfällen oder Materialverlusten
- Zeitverlust durch manuelles Tracking, doppelte Eingabe oder ineffiziente Kommunikation
Der ROI hängt nicht nur davon ab, was Sie gewinnen, sondern auch darin, was Sie nicht mehr verlieren.
Das Onboarding muss auch keine Unterbrechung sein. SciSure bietet einen strukturierten, kollaborativen Implementierungsprozess, der sich an die Größe, den Reifegrad und die Arbeitsabläufe jedes Labors anpasst. Labore beginnen in der Regel mit einem Kernfunktionsumfang — Schulung, Inventar, Sicherheit — und erweitern sich, wenn Komfort und Nutzung zunehmen. Die Mitarbeiter werden durch das Change Management geführt und müssen es nicht alleine bewältigen. Das Ergebnis ist ein reibungsloserer Übergang, eine schnellere Einführung und sofortige betriebliche Vorteile.
Um die Unterstützung von Führungskräften zu gewinnen, muss oft nachgewiesen werden, dass es bei der Prüfungsbereitschaft nicht nur darum geht, die Aufsichtsbehörden zufrieden zu stellen, sondern auch darum, die Widerstandsfähigkeit der Organisation zu stärken.
Wenn du es nicht beweisen kannst, kannst du ihm nicht vertrauen
Auditbereitschaft ist kein Kästchen mehr, das Sie ankreuzen müssen — sie spiegelt wider, wie Ihr Labor denkt, arbeitet und schützt, was am wichtigsten ist.
In einem Umfeld, in dem die Vorschriften kontinuierlich eingehalten werden, die Erwartungen steigen und der Ruf auf dem Spiel steht, ist das Hoffen auf das Beste keine Strategie mehr. Ganz gleich, ob es um Sicherheit, Schulung, Inventar oder wissenschaftliche Integrität geht, Ihre Systeme stellen entweder Risiken dar oder begrenzen sie.
Die Scientific Management Platform von SciSure bietet Ihnen die Transparenz, Kontrolle und Sicherheit, um Audits — und den damit verbundenen Störungen — immer einen Schritt voraus zu sein. Es geht nicht darum, mehr zu arbeiten. Es geht darum, intelligentere, sicherere und verantwortungsvollere Wissenschaft zu betreiben.
Bereit, von der Brandbekämpfung zur vollen Kontrolle überzugehen? Lass uns reden.
Referenzen
- Nasrallah, I.M., A.K. El Kak, L.A. Ismaiil, R.R. Nasr und W.T. Bawab. „Prävalenz von Unfällen unter wissenschaftlichen Laboranten der öffentlichen Universität im Libanon und die Auswirkungen von Sicherheitsmaßnahmen.“ Sicherheit und Gesundheit bei der Arbeit, Band 13, 2022, S. 155.
- „Übersetzung von Sicherheitspraktiken im Industrielabor an die Wissenschaft.“ AIche, Mai 2022, www.aiche.org/resources/publications/cep/2022/may/translating-industrial-lab-safety-practices-academia.
- Benderly, Beryl Lieff. „Was haben wir ein Jahrzehnt nach einer tödlichen Laborsicherheitskatastrophe gelernt?“ Wissenschaft, 2018, doi:10.1126/science.caredit.aaw2757.
- Baker, Monya und David Penny. „Gibt es eine Reproduzierbarkeitskrise?“ Natur, Bd. 533, 2016, S. 452—54.
Read more of our blogs about modern lab management
Discover the latest in lab operations, from sample management to AI innovations, designed to enhance efficiency and drive scientific breakthroughs.



.jpg)
