Your laboratory is ready for a audit or souhaitez-vous simplement que tout se passe pour le mieux ?
Découvrez comment préparer votre audit de laboratoire. Découvrez comment réduire les risques, améliorer la conformité et intégrer la traçabilité à la plateforme de gestion scientifique de SciSure.

Download Whitepaper
La plupart des laboratoires n'échouent pas aux audits à cause d'une seule erreur catastrophique. Ils échouent à cause d'une centaine de problèmes mineurs : tous invisibles, sans papiers et sans réponse jusqu'à ce qu'il soit trop tard.
C'est pourquoi être prêt à effectuer un audit est bien plus qu'un simple exercice à cocher. Il s'agit d'un puissant aperçu de la santé opérationnelle de votre laboratoire, qui révèle le fonctionnement réel de vos systèmes au quotidien. Et pour les laboratoires qui utilisent toujours des processus obsolètes, des feuilles de calcul éparpillées, des journaux de formation mis à jour manuellement ou une conformité qui dépend de la mémoire, les failles ne peuvent pas être flagrantes, jusqu'à ce qu'un audit, un incident ou une action en justice les révèlent.
C'est un pari que peu d'organisations peuvent se permettre. Aujourd'hui, les régulateurs, les organismes de financement et les parties prenantes internes mettent la barre plus haut, en exigeant non seulement de la documentation, mais aussi de la traçabilité. Pas seulement des politiques, mais des preuves. Être prêt pour un audit, ce n'est pas seulement le jour de l'inspection, c'est aussi chaque journée.
Mais si les attentes ont évolué, de nombreuses infrastructures de laboratoire n'ont pas évolué. Les systèmes existants, les solutions ponctuelles et les outils déconnectés ont créé des écosystèmes fragmentés où les risques se cachent à la vue de tous. Les solutions manuelles sont devenues des processus quotidiens. Et les systèmes de sécurité, d'inventaire et de formation fonctionnent souvent indépendamment de la recherche elle-même.
Ce livre blanc explique comment la préparation aux audits est devenue un indicateur essentiel des risques organisationnels et explique ce que les laboratoires peuvent faire pour garder une longueur d'avance. Nous examinons comment les systèmes fragmentés présentent des risques en termes de reproductibilité, de sécurité, de conformité et d'intégrité scientifique, ainsi que la manière dont les systèmes numériques intégrés tels que SciSure Scientific Management Platform (SMP) peut transformer la préparation à l'audit d'une difficulté en un avantage stratégique.
La préparation aux audits en tant que facteur clé de l'atténuation des risques
Être prêt pour les audits n'est pas simplement une étape de conformité, c'est un test de résistance pour l'ensemble des opérations de votre organisation. Quand tu demandes, « Sommes-nous prêts pour les audits ? », you ask you really :
- Nos données et dossiers sont-ils exacts, complets et accessibles ?
- Notre personnel est-il correctement formé et à jour ?
- Nos systèmes sont-ils suffisamment connectés pour fournir des réponses claires lorsque des questions sont posées ?
Si la réponse n'est pas, ou « C'est ce que nous pensons »—you courez déjà un risque.
Qu'il s'agit d'une surveillance réglementaire accrue, de défaillances de sécurité réelles ou de préoccupations croissantes concernant la reproductibilité scientifique, la préparation aux audits apparaît comme une garantie essentielle. Au-delà d'être un objectif de conformité, il s'agit d'une condition préalable structurelle à une science résiliente et crédible.
Les risques dans les environnements scientifiques peuvent se manifester de plusieurs manières :
- Rendement risk : La non-conformité peut entraîner des inspections, des amendes, des fermetures ou même des poursuites judiciaires.
- Operational risk : Une mauvaise visibilité entraîne des erreurs manquées, des tâches redondantes et des pratiques incohérentes.
- Risque d'atteinte à la réputation : Une faille de sécurité, un événement de contamination ou une seule citation peuvent nuire à la confiance pendant des années.
- Scientific risk : Si vous ne pouvez pas reproduire ou retracer votre travail, vous ne pouvez pas vous en tenir aux résultats.
Crise réglementaire croissante
Pour les laboratoires du monde entier, le contrôle réglementaire s'intensifie. En mai 2025, un décret exécutif américain intitulé »Améliorer la sûreté et la sécurité de la recherche biologique» a introduit des changements radicaux, obligeant les organisations scientifiques à mettre en œuvre des politiques de surveillance plus strictes. Cela comprend des clauses d'application, des rapports publics et des définitions actualisées de ce qui constitue une recherche risquée.
La politique s'applique notamment aux laboratoires financés par le gouvernement fédéral et non par le gouvernement, élargissant la supervision gouvernementale et obligeant les laboratoires à faire preuve d'une traçabilité transparente, à signaler les incidents de manière fiable et à certifier solidement le personnel. Dans la pratique, cela signifie une documentation complète des inventaires d'agents, des évaluations de sécurité, de la formation et des dossiers du personnel de laboratoire, ainsi que des journaux d'incidents vérifiables.
Conséquences pour la sécurité dans le monde réel
Les failles de sécurité dans les laboratoires scientifiques restent bien plus fréquentes que ne le pensent la plupart des organisations, et les répercussions peuvent être graves. Une étude observationnelle menée en 2021 auprès de 220 employés de laboratoire a révélé que 45 % ont déclaré avoir subi au moins un accident pendant leur travail de laboratoire.1. En outre, entre 2001 et 2018, le Chemical Safety and Hazard Investigation Board (CSB) des États-Unis a documenté 120 accidents survenus dans des laboratoires de recherche universitaires, notamment des fuites de produits chimiques, des incendies et des évacuations2. Ces incidents sont souvent liés à des contrôles procéduraux inadéquats, à une formation insuffisante et à une gestion fragmentée des dossiers.
L'un des cas les plus marquants reste le décès de Sheri Sangji, chercheuse à l'UCLA, qui a subi des brûlures mortelles en 2008 après avoir manipulé des réactifs pyrophoriques sans formation appropriée ni vêtements de protection.3. L'affaire pénale qui en a résulté a marqué la première poursuite américaine pour un accident dans un laboratoire universitaire, coûtant des millions de dollars à l'UCLA en frais juridiques et portant gravement atteinte à sa réputation.
Le coût de la réputation et de l'intégrité scientifique
Au-delà des amendes, des poursuites et des incidents de sécurité, un manque de préparation aux audits peut éroder l'atout le plus précieux d'une organisation scientifique : la confiance. Lorsque les données ne peuvent pas être tracées, reproduites ou validées, leur crédibilité, ainsi que la vôtre, est remise en question. Dans des domaines hautement réglementés tels que le développement de médicaments, le diagnostic et la recherche translationnelle, même des lacunes mineures en matière de documentation peuvent faire dérailler les soumissions réglementaires, bloquer les programmes cliniques ou compromettre le financement et les partenariats.
Les échecs de reproductibilité constituent une crise scientifique largement reconnue. UNE La nature Une enquête menée auprès de 1 500 scientifiques a révélé que plus de 70 % n'avaient pas réussi à reproduire les résultats d'un autre chercheur et que plus de 50 % n'avaient pas pu reproduire leurs propres résultats4. Bien que les causes soient multifactorielles, une mauvaise gestion des données et des dossiers incomplets en sont les principaux facteurs.
Dans ce contexte, être prêt pour les audits ne se limite pas à des inspections : c'est une garantie de l'intégrité scientifique. Il garantit que chaque étape, chaque échantillon et chaque décision sont enregistrés, accessibles et défendables. Sans cette base, même des résultats révolutionnaires risquent d'être rejetés, contestés ou complètement perdus. En termes simples : si vous ne pouvez pas le prouver, vous ne pouvez pas lui faire confiance, et personne d'autre non plus.
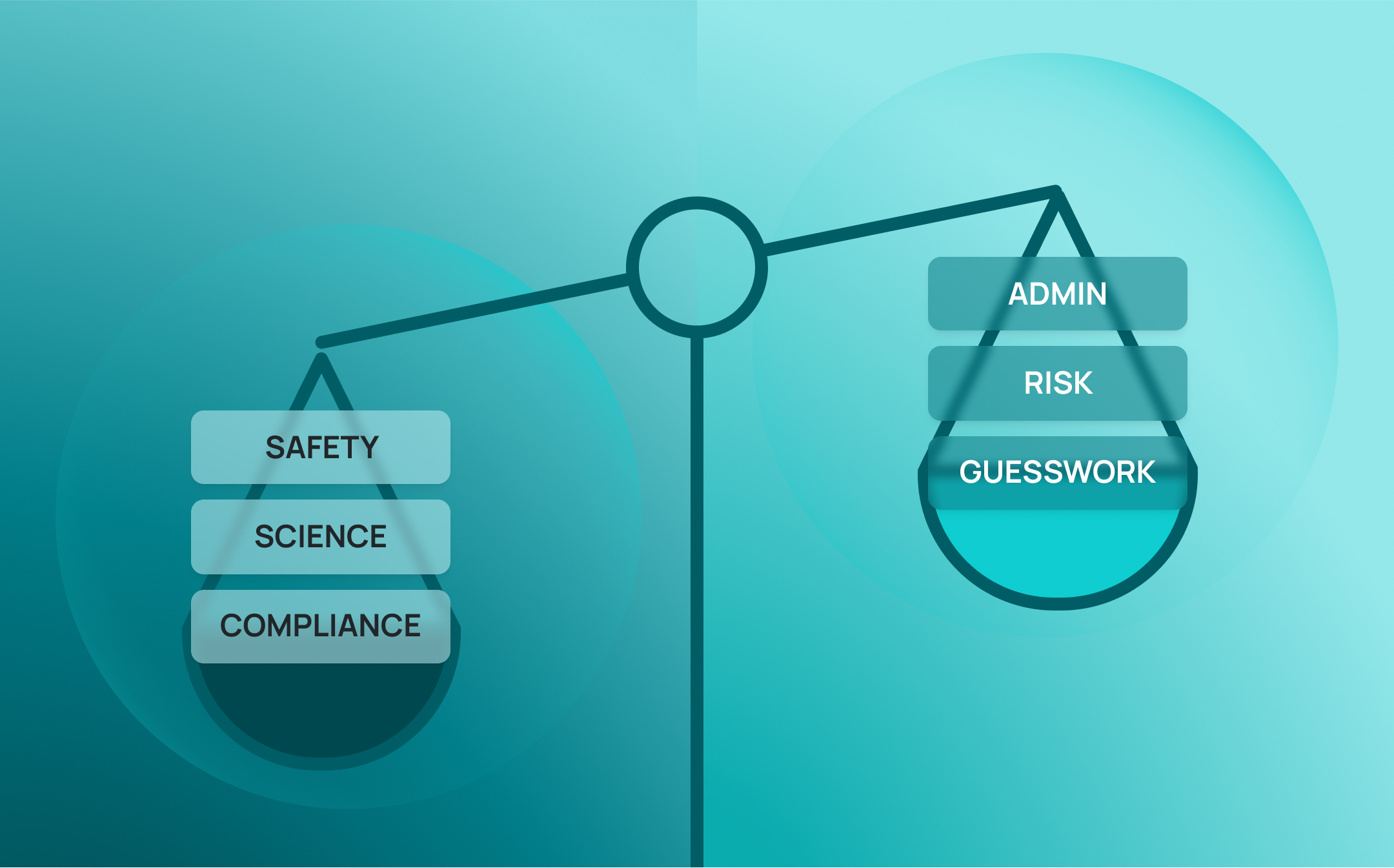
Les laboratoires réellement prêts pour les audits ne sont pas seulement préparés pour les inspections, ils sont équipés pour faire face aux imprévus. Ils fonctionnent avec des systèmes connectés, une supervision en temps réel et une traçabilité intégrée qui soutient les décisions quotidiennes. Dans cette optique, la préparation à l'audit devient bien plus qu'une simple case à cocher de conformité : c'est un indicateur avancé de l'intégrité opérationnelle, de la rigueur scientifique et de la fiabilité institutionnelle.
.jpg)
Où se trompent les laboratoires ?
La plupart des laboratoires ne sont pas en mesure de se préparer aux audits parce qu'ils manquent d'efforts ou d'expertise. Ils échouent souvent parce que leurs systèmes n'ont jamais été conçus pour cela.
Les risques liés à l'audit ont tendance à s'accroître lentement, sous l'effet de l'accumulation de petites lacunes et de solutions manuelles qui passent inaperçues jusqu'à ce qu'il soit trop tard. En matière de formation, d'inventaire, de sécurité et de documentation, de nombreux laboratoires s'appuient toujours sur des processus fragmentés, réactifs et difficiles à vérifier.
Les points faibles les plus courants sont les suivants :
- Manuel de formation et de compétences: Les certifications du personnel sont souvent enregistrées sur des feuilles de calcul ou des formulaires papier, sans aucune alerte automatique à l'expiration de la formation. Il est donc difficile de s'assurer que le personnel est qualifié, et impossible de le prouver lors d'un audit sans difficulté.
- Systèmes de sécurité Cloisoner: Les audits de sécurité, les inventaires de produits chimiques et les rapports d'incidents sont fréquemment suivis dans des outils déconnectés, indépendamment des flux de travail où le risque se produit réellement. Cela laisse des lacunes en matière de traçabilité et rend plus difficile l'identification des problèmes systémiques.
- Obsolète gestion des stocks: Les laboratoires ont souvent du mal à suivre les réactifs, les échantillons et les actifs en temps réel. Sans registres d'inventaire fiables, il est difficile de maintenir la chaîne de traçabilité ou d'identifier les matériaux périmés ou mal utilisés, ce qui constitue un signal d'alarme majeur lors de toute inspection.
- Solutions ponctuelles isolées: Même lorsque des outils numériques existent, il s'agit souvent d'applications à usage unique qui ne s'intègrent pas. Cela oblige les équipes à dupliquer les données entre les systèmes ou, pire encore, à opérer à partir de versions contradictoires de la vérité.
- Cultural habitudes and institutional memory: Dans de nombreux laboratoires, les connaissances essentielles résident dans la tête d'un personnel expérimenté. Mais lorsque ces connaissances ne sont pas documentées ou facilement accessibles, la rotation du personnel ou les absences peuvent rapidement créer des angles morts.
- Reactive spirit state: Trop souvent, les problèmes ne sont résolus qu'après un problème : une faille de sécurité, une inspection ratée, une validation manquée. D'ici là, il sera trop tard pour être proactif.
Ces lacunes font des audits un casse-tête pour les laboratoires, mais elles créent également des risques au quotidien. Sans systèmes connectés et vérifiables, les laboratoires fonctionnent sur des hypothèses : en supposant que quelqu'un a terminé la formation, en supposant que l'échantillon a été enregistré, en supposant que la procédure a été suivie. Lorsque les régulateurs, les partenaires ou les dirigeants demandent des preuves, « nous le pensons » ne suffit pas.
Peux-tu repérer le risque ?
Imaginez ce scénario : Un auditeur demande la preuve qu'un technicien a été formé à un nouveau protocole à haut risque mis en place il y a deux mois. Vous vous souvenez clairement de la session de formation, mais la feuille de calcul n'a pas été mise à jour et aucune signature n'est enregistrée. Entre-temps, les noms des membres du personnel ayant suivi la formation étaient copiés à la main sur un post-it qui n'a jamais été intégré au système. Ce qui a commencé comme une routine ressemble aujourd'hui à une violation de la réglementation.
Verification rapide de la réalité :
- Pouvez-vous récupérer les dossiers de formation à jour pour chaque membre du laboratoire en moins de 5 minutes ?
- Pouvez-vous indiquer la chaîne de contrôle d'un réactif ou d'un échantillon critique utilisé dans votre dernière soumission réglementaire ?
- Vos SOP sont-elles contrôlées par version, accessibles à tous et intégrées à vos flux de travail quotidiens ?
La bonne nouvelle, c'est que ces risques ne sont pas inévitables. Les laboratoires qui réussissent régulièrement les audits ne comptent pas sur des efforts héroïques. Ils s'appuient sur des systèmes conçus pour la visibilité, la traçabilité et la conformité par défaut. Au lieu d'essayer de combler les lacunes en utilisant davantage de feuilles de calcul ou de listes de contrôle, ils investissent dans une infrastructure qui intègre la préparation aux audits dans le tissu des opérations quotidiennes.
De la préparation réactive à la préparation proactive aux audits
Dans un laboratoire prêt à être audité, la conformité n'est pas une chose à laquelle vous vous préparez, mais une chose que vous maintenez. Il est intégré à vos activités quotidiennes, et non superposé à celles-ci. Et surtout, c'est visible. Être prêt pour les audits signifie que votre laboratoire peut répondre à des questions critiques de manière cohérente, rapide et avec des preuves :
- Qui a manipulé cet échantillon et quand ?
- Le protocole a-t-il été suivi exactement comme il avait été approuvé ?
- L'équipe a-t-elle été formée et a-t-elle approuvé la dernière SOP ?
- Où était stocké ce produit chimique et quand a-t-il expiré ?
- Quelles mesures correctives ont été prises à la suite du dernier incident de sécurité ?
Dans les laboratoires dépourvus de l'infrastructure numérique adéquate, ces réponses se trouvent dans une douzaine d'endroits différents : feuilles de calcul, classeurs, ou pire encore, dans la mémoire de quelqu'un. C'est pourquoi être prêt pour les audits ne se limite pas à la documentation. Il s'agit de la conception du système.
Les laboratoires réellement prêts à être audités partagent quatre caractéristiques :
.jpg)
- Connecté — Les données sont centralisées et les systèmes communiquent entre eux, de sorte que l'inventaire, la formation, la sécurité et la recherche ne sont pas cloisonnés.
- traçable — Chaque matériel, chaque action et chaque décision peuvent être retracés jusqu'à une personne, une heure et un enregistrement.
- Controllé — Les procédures opérationnelles normalisées, les flux de travail et les autorisations sont appliqués par le système, et non pas supposés ni contournés manuellement.
- Visible — Les problèmes sont signalés rapidement, les tendances sont suivies en temps réel et les auditeurs n'ont pas à fouiller pour trouver ce dont ils ont besoin.
Comment le SMP de SciSure rend cela possible
Le SciSure SMP a été conçu pour créer des laboratoires prêts pour les audits par défaut. Il regroupe les composants essentiels de la gestion des laboratoires (ELN, LIMS, inventaire, équipement, formation, sécurité, inspections, etc.) dans un environnement intégré unique. Au lieu de se connecter à dix systèmes numériques différents ou de recourir à des solutions manuelles, les utilisateurs interagissent avec une plateforme unifiée qui reflète les flux de travail réels des laboratoires.
Une formation vérifiable et non supposée
Le SMP comble les lacunes en matière de visibilité de la formation en liant directement la formation aux rôles et responsabilités des utilisateurs. L'accès de chaque membre du laboratoire est régi par un programme de formation clair qui associe les certifications requises aux tâches autorisées. Si la formation est incomplète ou obsolète, le système empêche activement les utilisateurs de lancer des protocoles à haut risque ou de manipuler des matériaux sensibles.
Les dossiers sont stockés de manière centralisée et mis à jour en temps réel, ce qui élimine le besoin de fouiller dans les fichiers RH ou de recouper manuellement les feuilles de calcul. Les alertes et les tableaux de bord tiennent les scientifiques et les responsables informés en un clin d'œil des prochains renouvellements, des formations expirées et de la conformité à l'échelle de l'équipe.
Bref, ce n'est pas laissé à la mémoire ni à une surveillance manuelle. La plateforme fait office de gardien intégré, garantissant que seules les bonnes personnes, dotées de la bonne formation, peuvent effectuer le bon travail.
Données de sécurité intégrées au flux de travail scientifique
Dans la plupart des laboratoires, les données de sécurité sont stockées dans un silo, liées à des formulaires papier, à des plateformes EHS distinctes ou à des processus de reporting ad hoc qui ne sont pas intégrés au travail de laboratoire réel. Le SciSure SMP élimine cette déconnexion en intégrant la sécurité directement à la façon dont la science est menée.
Les évaluations des risques et les contrôles de sécurité sont intégrés aux protocoles eux-mêmes, et non intégrés par la suite. Les chercheurs sont guidés à travers les étapes requises, les contrôles de danger et les rappels relatifs à l'équipement de protection individuelle au fur et à mesure des flux de travail, de sorte que la sécurité devient automatique et non facultative.
Lorsque des incidents surviennent, ils ne sont pas traités de manière isolée. Le système les relie à des flux de travail, à des utilisateurs et à des réactifs spécifiques, ce qui vous fournit des données contextuelles riches pour l'analyse des causes profondes. Et comme l'inventaire des produits chimiques est suivi en temps réel, jusqu'à chaque bouteille, il est facile de déterminer quels matériaux étaient concernés, si les limites de stockage ont été dépassées ou si des substances incompatibles ont été utilisées ensemble.
Cela crée un cercle vertueux : les données de sécurité éclairent les décisions futures, les tendances deviennent visibles et la responsabilité est intégrée dès le départ. Plutôt que de s'appuyer sur des rapports réactifs, le laboratoire instaure une culture d'amélioration continue, dans laquelle les risques sont repérés et traités avant qu'ils ne deviennent une crise.
Inventaire, échantillons et chaîne de traçabilité
Le SMP centralise l'ensemble du cycle de vie des réactifs, des produits chimiques et des échantillons, de la commande à la réception, en passant par l'utilisation, le stockage et l'élimination. Chaque mouvement est enregistré avec des horodatages, une attribution utilisateur et des métadonnées contextuelles, garantissant ainsi une chaîne de traçabilité complète avec un minimum d'effort manuel.
Étant donné que l'inventaire est directement lié aux flux de travail, le système peut restreindre l'utilisation de matériaux périmés ou non autorisés, appliquer des pratiques de stockage appropriées et garantir que seules des entrées validées sont utilisées dans les procédures réglementées. En cas de problème, ou si un auditeur souhaite retracer le parcours d'un échantillon critique, chaque étape est documentée et facile à récupérer.
Il en résulte un contrôle renforcé, moins d'angles morts en matière de conformité et un dossier scientifique plus solide.
Des tableaux de bord qui rendent les risques visibles
Être prêt pour les audits, c'est savoir à tout moment où en est votre laboratoire. Avec SciSure, la visibilité est intégrée à la plateforme à tous les niveaux.
Les tableaux de bord fournissent aux responsables de laboratoire et aux équipes EHS des informations en temps réel sur l'état de la formation, les SOP en retard, les incidents en cours, etc. Les autorisations spécifiques aux rôles permettent à chaque utilisateur de voir ce qui est pertinent pour ses responsabilités, qu'il s'agit d'un responsable de la conformité qui examine les inspections précédentes ou d'un scientifique qui vérifie la disponibilité des réactifs.
Chaque action est enregistrée avec une piste d'audit complète, indiquant qui a fait quoi, quand et selon quelle version du protocole. Rien n'est caché, rien n'est perdu et rien n'a besoin d'être reconstruit après coup. Lorsque les auditeurs arrivent, vous n'avez pas à vous bousculer pour collecter les documents. Vous opérez déjà avec la transparence qu'ils attendent.
En alignant les opérations des laboratoires sur une seule plateforme connectée, SciSure aide les laboratoires à passer d'un brouillage réactif à un contrôle proactif. Au lieu de s'appuyer sur la mémoire, des solutions de contournement ou des systèmes déconnectés, les laboratoires fonctionnent dans un environnement numérique qui applique les normes, signale les risques et favorise la traçabilité dès la conception.
Cela permet non seulement de réduire le stress lié aux inspections, mais aussi de protéger votre personnel, votre science et votre réputation.
Transformer l'atténuation des risques en retour sur investissement
Pour de nombreux directeurs de laboratoire et responsables EHS, le principal obstacle à l'amélioration de la préparation aux audits n'est pas la sensibilisation, mais l'action. Même lorsque les risques sont évidents, il peut être difficile de convaincre les dirigeants d'investir dans une nouvelle plateforme. Les budgets sont serrés, les systèmes existants sont bien ancrés et le coût de l'inaction est souvent sous-estimé.
Mais la préparation à l'audit devient de plus en plus un impératif commercial. Les risques de non-conformité, de failles de sécurité ou de perte de données peuvent entraîner des coûts exorbitants sous forme de frais juridiques, d'amendes réglementaires, d'interruptions opérationnelles ou d'atteinte à la réputation. Et ces coûts dépassent souvent de loin les investissements nécessaires pour résoudre les problèmes sous-jacents.
C'est pourquoi le meilleur moyen d'obtenir l'adhésion à des plateformes telles que le SMP de SciSure est de définir l'atténuation des risques comme un contrôle des coûts. En passant d'une supervision réactive à une visibilité en temps réel, les laboratoires peuvent réduire :
- La charge financière liée à la préparation des audits
- Redondance des systèmes de formation, de documentation et d'inventaire
- Coûts associés aux incidents de sécurité ou à la perte de matériel
- Temps perdu en raison d'un suivi manuel, d'une double saisie ou d'une communication inefficace
Le retour sur investissement ne réside pas uniquement dans ce que vous gagnez, mais dans ce que vous ne perdez plus.
L'intégration n'a pas non plus besoin d'être une interruption. SciSure propose un processus de mise en œuvre structuré et collaboratif qui s'adapte à la taille, à la maturité et au flux de travail de chaque laboratoire. Les laboratoires commencent généralement par un ensemble de fonctionnalités de base (formation, inventaire, sécurité) et s'étendent à mesure que le confort et l'utilisation augmentent. Le personnel est guidé tout au long de la gestion du changement, et non pas laissé à lui-même. Il en résulte une transition plus fluide, une adoption plus rapide et des avantages opérationnels immédiats.
Obtenir l'adhésion de la direction revient souvent à montrer que la préparation à l'audit ne se limite pas à satisfaire les régulateurs, mais aussi à renforcer la résilience de l'organisation.
Si vous ne pouvez pas le prouver, vous ne pouvez pas vous y fier
La préparation aux audits n'est plus une case à cocher, elle reflète la façon dont votre laboratoire pense, travaille et protège ce qui compte le plus.
Dans un environnement où la conformité est continue, les attentes augmentent et la réputation est en jeu, espérer le meilleur n'est plus une stratégie. Qu'il s'agit de sécurité, de formation, d'inventaire ou d'intégrité scientifique, vos systèmes créeront des risques ou les limiteront.
La plateforme de gestion scientifique de SciSure vous offre la visibilité, le contrôle et la confiance nécessaires pour garder une longueur d'avance sur les audits et les perturbations qu'ils peuvent entraîner. Il ne s'agit pas de travailler davantage. Il s'agit de mener une science plus intelligente, plus sûre et plus responsable.
Prêt à passer de la lutte contre les incendies au contrôle total ? Parlons-FR.
Références
- Nasrallah, I.M., A.K. El Kak, L.A. Ismaiil, R.R. Nasr et W.T. Bawab. « Prévalence des accidents chez les travailleurs des laboratoires scientifiques de l'université publique du Liban et impact des mesures de sécurité ». Sécurité et santé au travail, volume 13, 2022, p. 155.
- « Traduire les pratiques de sécurité des laboratoires industriels au monde universitaire. » AIche, mai 2022, www.aiche.org/resources/publications/cep/2022/may/translating-industrial-lab-safety-practices-academia.
- Benderly, Beryl Lieff. « Dix ans après une catastrophe fatale en matière de sécurité dans un laboratoire, qu'en avons-nous appris ? » Science, 2018, doi:10.1126/science.cardit.aaw2757.
- Baker, Monya et David Penny. « Y a-t-il une crise de reproductibilité ? » La nature, volume 533, 2016, pages 452 à 454.
Read more of our blogs about modern lab management
Discover the latest in lab operations, from sample management to AI innovations, designed to enhance efficiency and drive scientific breakthroughs.



.jpg)
